Pembahasan Tryout Saintek Kimia 1
-
- 3-metil-2-butanol
- 2-metil-2-butanol
- 3-metil-3-butanol
- 3-etil-1-propanol
- 3-pentanol
Jawaban : aSenyawa yang memiliki rumus molekul C5H12O, yaitu alkohol dan eter. Antara keduanya yang dapat mengalami oksidasi adalah alkohol.
Alkohol primer bila dioksidasi akan menghasilkan senyawa aldehid dan jika dioksidasi lagi akan menghasilkan asam karboksilat sedangkan alkohol sekunder bila dioksidasi akan menghasilkan senyawa keton. Pada opsi di atas, senyawa alkohol yang dapat dengan mungkin berubah menjadi senyawa keton adalah pilihan A. Pilihan B mempunyai cabang pada atom karbon yang terikat dengan gugus OH sehingga sulit untuk menjadi senyawa keton, sedangkan pilihan C terdapat kesalahan pada tata nama.
-
Suatu cuplikan hanya mengandung unsur nitrogen dan oksigen. Bila dalam 152 gram cuplikan terdapat 56 gram nitrogen, maka rumus empiris senyawa tersebut adalah ....
(ArN:14, O:16)
- N2O5
- N2O3
- N2O
- NO2
- NO
Jawaban : bCuplikan mengandung N dan O saja.
Massa cuplikan 152 gram
Massa nitrogen 56 gram.
Massa oksigen = 152 gram – 56 gram = 96 gram
Rumus empiris dari perbandingan terkecil mol atom N dan O yaitu
mol N : mol O = 56/14 : 96/16
= 4 : 6
= 2 : 3
-
Alkohol sekunder dapat diubah menjadi keton dengan menggunakan KMnO4 atau K2Cr2O7 menurut persamaan reaksi:
R1 – CHOH – R2 → R1 – CO – R2
Jenis reaksi yang terjadi adalah ....
- eliminasi
- reduksi
- hidrolisis
- substitusi
- adisi
Jawaban : aPerubahan terjadi pada gugus fungsi alkohol dan keton.
R1 – CHOH – R2 → R1 – CO – R2
Dari reaksi tersebut, terjadi pembuangan 2 atom H (pada -CHOH-) di kiri panah menjadi CO saja di kanan panah. Reaksi pembuangan atom itu disebut sebagai reaksi eliminasi.
-
Jawaban : a
Untuk membuat hibridisasi yang dilihat adalah atom pusat. Pada senyawa XeF4 yang menjadi atom pusat adalah Xe.
Konfigurasi elektron 54Xe = [Kr] 5s2 4d10 5p6
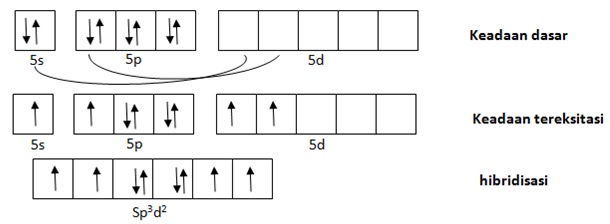
-
Sebanyak 4,16 gram gas A terbentuk dari reaksi antara 1 liter gas NO2 dan gas O2 berlebih menurut reaksi
4NO2(g) + O2(g) → 2A(g)
Jika reaksi tersebut berlangsung pada suhu 300C dengan tekanan 2 atm, maka massa molekul relatif gas A adalah .... (R=0,082 liter atm/mol K)
76
104
112
224
316
Jawaban : bMassa gas A 2,24 gram
Suhu 300C + 273 =303 K
Tekanan 2 atm
Persamaan reaksi
4NO2(g) + O2(g) → 2A(g)
1 liter 0,5 liter
Persamaan gas ideal
P V = n R T
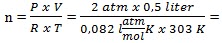 0,04 mol
0,04 molmaka Mr =
 = 104 g/mol
= 104 g/mol -
Suatu sel elektrokimia dengan elektrode Zn dan Ag pada keadaan standar menghasilkan arus 0,75 A selama 321 menit. Diketahui nilai
E0 Zn2+ I Zn = - 0,76 V
E0 Ag+ I Ag = + 0,8 V
Maka pengurangan massa di anoda adalah .... gram (F = 96.500 C)
Jawaban : bKatoda : Ag+ + e → Ag
Anoda : Zn → Zn2+ + 2e-
Wanoda =
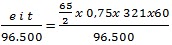 = 4,875 gram
= 4,875 gram -
Proses pemurnian belerang yang dilakukan oleh Frasch dikenal juga dengan proses penambangan sumur panas. Konsep kerjanya adalah dengan mengalirkan air panas kedalam sumur galian yang terdapat deposit belerang, sehingga belerang akan meleleh dan mengapung pada permukaan air. Namun diawal proses ini, Frasch mengalami permasalahan. Suhu tertinggi dari air panas adalah 100oC, namun belerang memiliki titik lebur pada suhu 101,6o C.
Analisis, cara manakah di bawah ini yang paling tepat untuk menyelesaikan masalah yang dihadapai Frasch? (diketahui
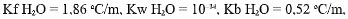 Ar S = 32 g/mol, Ar H = 1 g/mol, O = 16 g/mol).Jawaban : b
Ar S = 32 g/mol, Ar H = 1 g/mol, O = 16 g/mol).Jawaban : b(A) Jawaban A salah, karena menaikan tekanan air akan menggugurkan tanah meningkatkan sedimen, sehingga lebih sulit untuk mendapat belerang murni.
(B) Jawaban B benar. Menambahkan 0,09 kg NaCl atau 90 gram NaCl disetiap liter air akan menaikan suhu air sekitar 1,6oC (sehingga titik didih menjadi air 101,6oC) dan sama dengan titik leleh belerang dalam deposit, sehingga belerang akan didapatkan.
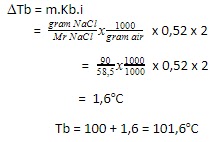
(C) Jawaban C salah. Menambahkan HCl akan merusak alat – alat pertambangan yang umumnya dari logam.
(D) Menambahkan alkohol 10% pada setiap liter air tidak berpengaruh, karena belerang tidak larut dalam alkohol.
(E) Meningkatkan volume air yang masuk tidak akan mempengaruhi, karena konsep kerjanya adalah melelehkan belerang.
-
Diketahui reaksi redoks (belum setara):
PbSO4(s)+H2O(l)→Pb(s)+PbO2(s)+H2SO4(aq)
Pernyataan berikut ini yang benar adalah ....
- PbSO4 berperan sebagai oksidator
- PbSO4 berperan sebagai reduktor
- Pada akhir reaksi pH laturan lebih kecil dari 7
- Perbandingan mol PbSO4 terhadap H2O adalah 1:2
Jawaban : a
Pernyataan yang benar adalah 1, 2, dan 3.
-
Jawaban : b

-
30
60
120
180
360
Jawaban : b
Sehingga dapat dimasukkan:

-
Jawaban : d
Berdasarkan hukum Gay Lussac, untuk reaksi gas maka perbandingan volume = perbandingan koefisien gas – gas yang terlibat dalam reaksi
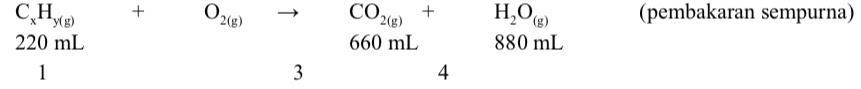
Sehingga,

-
Jawaban : e
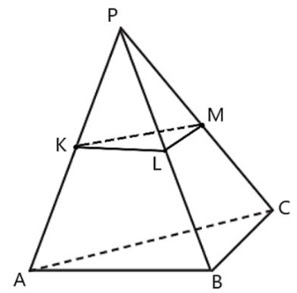
Jika panjang rusuk tegak limas P.ABC adalah a, b, c dan tinggi t maka limas P.KLM memiliki panjang rusuk tegak ½ a, ½ b, ½ c, dan tinggi ½ t
Perbandingan volume limas P.KLM dengan limas terpancung ABC KLM adalah:
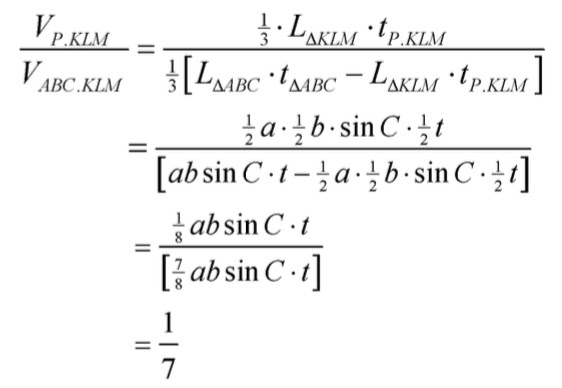
-
Berikut merupakan persamaan reaksi pembentukan gas SO3:
SO2(g) + O2(g) → SO3(g)
Jika gas oksigen yang digunakan sebanyak 12 L, maka volume gas SO3 yang dihasilkan adalah....
Jawaban : dPersamaan reaksi setara untuk penguraian gas SO3 adalah sebagai berikut:
2SO2 (g) + O2 (g) → 2SO3 (g)
Menurut hukum Gay Lussac, perbandingan volume spesi dalam reaksi fase gas sebanding dengan koefisien spesi tersebut.
Jika volume gas O2 = 12 L, maka:
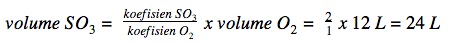
-
- PbO2 + 4HCl → PbCl2 + 2H2O + Cl2
- 2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
- CS2 + 3O2 → CO2 + SO2
- ZnSO4 + KCl → ZnCl2 + K2SO4
Jawaban : aReaksi redoks adalah reaksi kimia yang ditandai dengan kenaikan biloks (oksidasi) sekaligus penurunan biloks (reduksi).
Persamaan reaksi 1,2 dan 3 merupakan redoks.
Sedangkan persamaan reaksi 4 bukan redoks, karena tidak terjadi kenaikan maupun penurunan biloks.
-
Jawaban : b
Persamaan reaksi
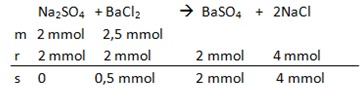
1) Na2SO4 sebagai reaksi pembatas (benar)
2) Sisa [Ba2+] = 0,5 mmol/100ml = 5 x 10-5 M (salah)
3) Ksp BaSO4 = 1,0 x 10-10, maka kelarutannya dalam air
BaSO4 → Ba2+ + SO42-
Ksp = s s
Ksp = s2
S =
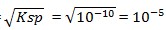 M (benar)
M (benar)4)
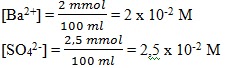
Maka Q = [Ba2+] [SO42-]
= 2 x 10-2 x 2,5 x 10-2 = 5 x 10-4
Nilai Q > Ksp, maka terbentuk endapan BaSO4 ( salah)
-
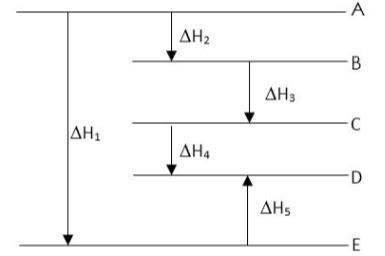
Pernyataan berikut ini yang benar mengenai diagram energi di atas adalah....
Jawaban : c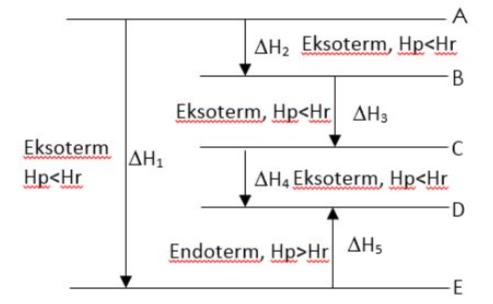
Pada reaksi ekstorem, terjadi perpindahan kalor dari sistem ke lingkungan, sehingga suhu lingkungan akan meningkat. Sebaliknya, pada reaksi endoterm terjadi perpindahan kalor dari lingkungan ke sistem. Sehingga suhu lingkungan akan menurun (menjadi lebih dingin).
-
Jawaban : b
Ikatan hidrogen adalah ikatan antarmolekul yang terjadi antara atom atom H dalam satu molekul dengan atom yang lebih elektronegatif yaitu O, N, F pada molekul lain. Karena pada molekul H2O terdapat molekul O dan H, dan pada molekul C2H5OH juga mempunyai ikatan O dan H pada gugus fungsi alkohol sehingga nomor 1 dan 3 akan berinteraksi dengan ikatan hidrogen. Gambaran interaksi antarmolekul H2O dan C2H5OH adalah sebagai berikut:
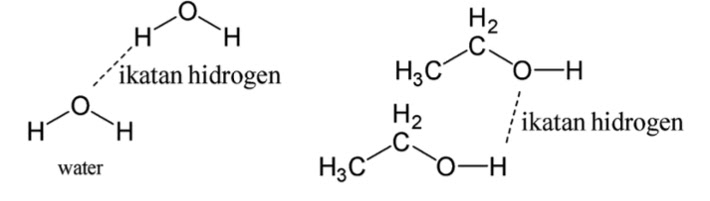
-
Asam butanoat merupakan isomer gugus fungsi dari metil propanoat.SEBABAsam butanoat dan metil propanoat memiliki rumus molekul C4H8O2.Jawaban : a
Asam butanoat merupakan turunan alkana yaitu asam karboksilat atau asam alkanoat dengan struktur
CH3 – CH2 – CH2 – COOH
Sedangkan metil propanoat merupakan turunan alkana yaitu ester atau alkil alkanoat dengan struktur
CH3 – CH2 – COO – CH3
Keduanya merupakan isomer gugus fungsi karena memiliki rumus molekul sama yaitu C4H8O2 tapi gugus fungsinya berbeda. Pada asam karboksilat gugus fungsinya –COOH sedangkan pada ester gugus fungsinya –COO–.
-
Nomor atom X adalah 26. Konfigurasi elektron ion X3+ adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d3.SEBABIon X3+, artinya atom X melepas 3 elektron terluarnya.Jawaban : d
Konfigurasi elektron atom 26X adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
Ion X3+, artinya atom X melepas 3 elektron terluarnya, maka elektron yang terlepas dari orbital 4s kemudian 3d.
Sehingga konfigurasi elektron ion 26X3+ adalah 1s2 2s2 2p6 3s2 3p6 4s0 3d5.
-
SEBABJawaban : a
Asam kuat H2SO4 dengan pH =1
[H+] = 10-1
[H+] = a Ma , Ma =
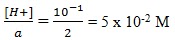
Dilakukan pengenceran 100 kali, misal V1 = 1 ml maka V2 = 100 ml
Maka M2 menjadi
M1 V1 = M2 V2
M2 =
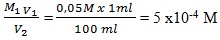
pH setelah pengenceran
[H+] = a Ma
[H+] = 2 x 5 x10-4 = 10-3
pH = -log 10-3 = 3
jadi pernyataan larutan asam kuat H2SO4 dengan pH =1 diencerkan 100 kali, maka pH larutan menjadi 3 itu benar. Alasannya, Jumlah ion H+ dalam larutan berubah menjadi sedikit bila larutan diencerkan.